CLDN18.2靶向药获批上市,华大基因为胃癌治疗新星靶点提供高质量检测
2025-01-08
01 CLDN18.2:胃癌治疗的新希望
12月31日,中国国家药品监督管理局 (NMPA) 宣布批准安斯泰来自主研发的全球首款靶向Claudin 18.2 (CLDN18.2) 抗体药物佐妥昔单抗在国内上市。该药联合含氟尿嘧啶类和铂类药物化疗用于CLDN18.2阳性、人表皮生长因子受体2 (HER2) 阴性的局部晚期不可切除或转移性胃或胃食管交界处 (GEJ) 腺癌患者的一线治疗。

图1. NMPA官网宣布批准佐妥昔单抗国内上市申请
CLDN18.2是一种由CLDN18基因编码的细胞表面分子蛋白,主要功能是维持细胞间的连接。CLDN18.2通常主要埋藏在正常胃黏膜中,但当肿瘤细胞的恶性增殖破坏了细胞间的紧密连接,就会导致肿瘤细胞表面的CLDN18.2表位暴露。
在胃癌、胰腺癌、食管癌以及肺癌等多种肿瘤中,均观察到CLDN18.2的高表达。在全球范围内针对胃癌和GEJ的Ⅲ期临床试验中,CLDN18.2的阳性率大约为35%至40%。在HER2阴性的患者中,CLDN18.2的阳性率高达42.3%。
因此CLDN18.2被当作胃癌领域继HER2后的第二个重要靶点[1],其高表达特性使得针对该靶点的治疗成为新的研究热点。佐妥昔单抗的获批上市,标志着胃癌治疗迈入了一个新阶段。
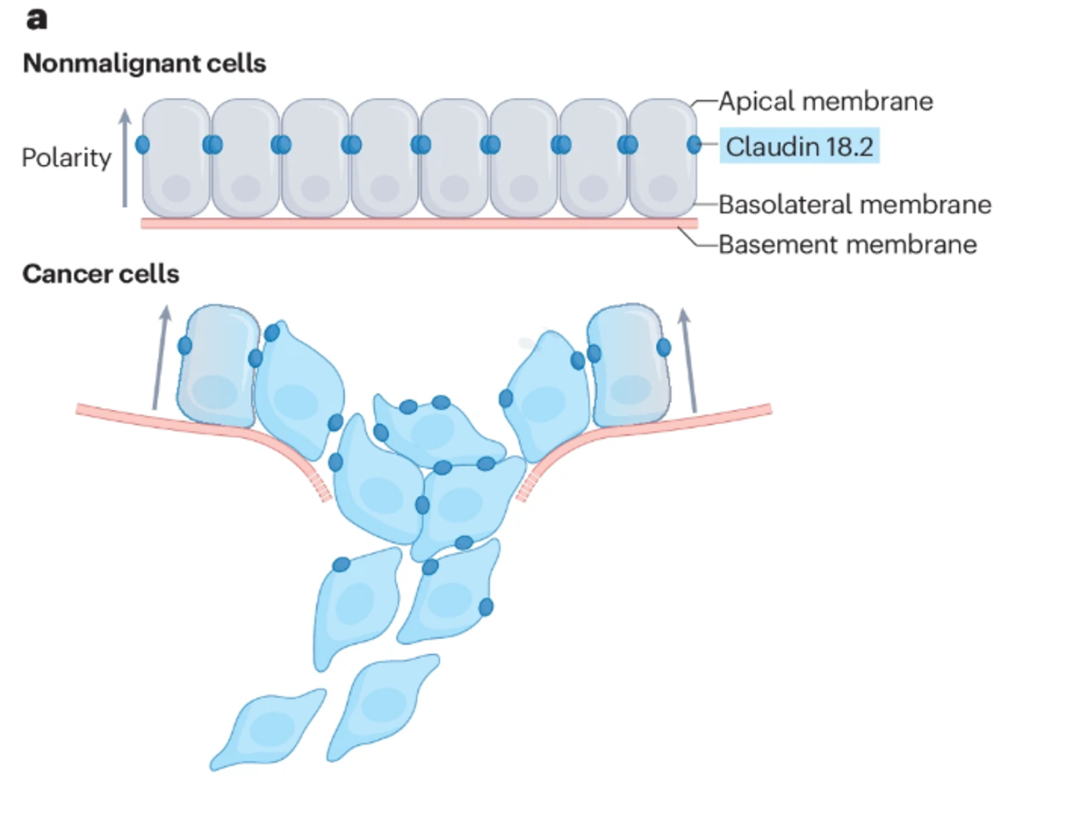
图2. CLDN18.2在肿瘤组织的表达
02 佐妥昔单抗:CLDN18.2靶点的首款治疗药物
佐妥昔单抗是全球首款针对CLDN18.2靶点的IgG1单克隆抗体[2],也是目前唯一获批的CLDN18.2靶向治疗药物。该药物通过与肿瘤细胞表面的CLDN18.2特异性结合,激活两种不同的免疫系统途径 (抗体依赖性细胞毒性和补体依赖性细胞毒性),诱导肿瘤细胞死亡,从而达到肿瘤治疗的目的。其上市基于两项III期临床研究 (SPOTLIGHT和GLOW) 的显著生存获益结果,为CLDN18.2阳性的胃癌患者提供了新的治疗选择。
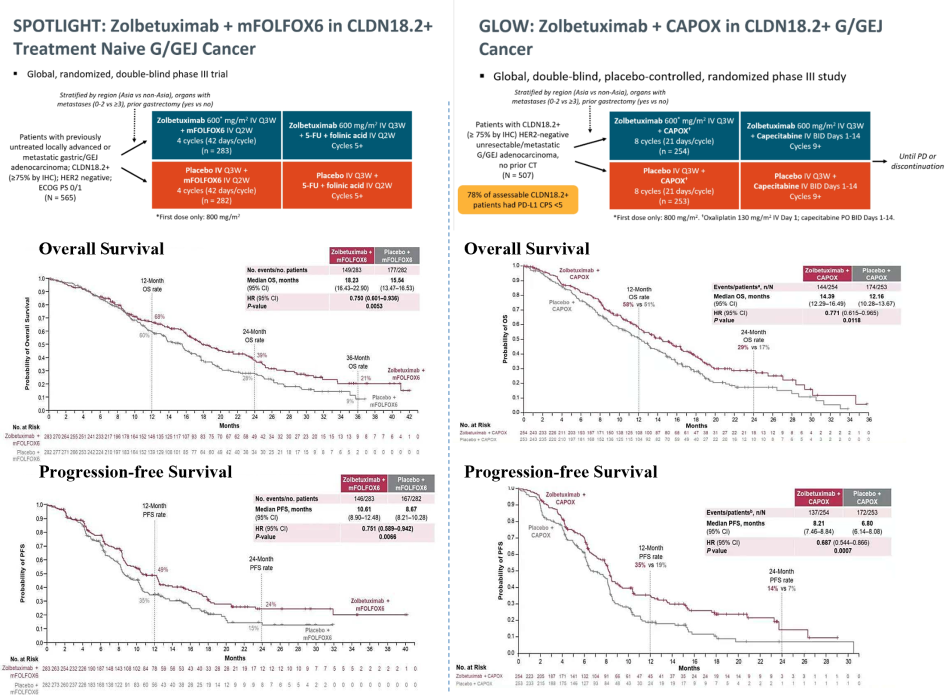
图3. 佐妥昔单抗Ⅲ期临床试验SPOTLIGHT和GLOW结果
佐妥昔单抗药物说明书及多项临床试验 (SPOTLIGHT、GLOW、ILUSTRO等) 中将CLDN18.2阳性定义为:免疫组化检测CLDN18中染色 (2+) 强度和强染色 (3+) 强度阳性肿瘤细胞总和≥75%。该标准不仅适用于判断患者是否属于佐妥昔单抗适用的CLDN18.2阳性人群 (阳性率范围约38.2%~46.2%),并可作为其他CLDN18.2靶向药物临床试验入组的参考[3,4,5]。

图4. 佐妥昔单抗药物阳性判读标准
03 CLDN18.2免疫组化检测的重要性
为了准确判断患者是否适合接受佐妥昔单抗治疗,CLDN18.2的蛋白表达检测至关重要。2024版CSCO胃癌诊疗指南将CLDN18.2蛋白表达检测的推荐等级从2023年的Ⅲ级提升至Ⅱ级[6,7],凸显了其重要性。目前检测CLDN18.2蛋白表达水平的方法主要是免疫组化法,而抗体是免疫组化检测关键因素,决定了检测的准确性和特异性。

图5. CSCO胃癌诊疗指南2024版
04 华大基因提供高质量的CLDN18.2蛋白表达检测服务
华大基因依托其专业平台,采用目前唯一获FDA批准的佐妥昔单抗伴随诊断抗体试剂 (克隆号:43-14A),为胃癌患者提供高质量的CLDN18.2蛋白表达检测服务。该抗体具有特异性强、亲和力高、检测灵敏度高、染色稳定性强等特点,能够准确判断患者是否属于佐妥昔单抗适用的CLDN18.2阳性人群。
此外,华大基因在肿瘤诊疗领域持续进步,新推三款免疫组化检测产品,包括CLDN18.2蛋白表达检测、TROP2蛋白表达检测、FRα蛋白表达检测,精准响应新兴抗肿瘤药物靶点检测需求。检测服务依托资质齐全的检测平台,由资深病理专家专业化判读,检测周期为7个自然日,高效助力临床诊疗决策与科研精准筛选。
随着佐妥昔单抗等针对CLDN18.2靶点的治疗药物的上市,胃癌患者的治疗选择将更加多样。而华大基因提供的高质量CLDN18.2蛋白表达检测服务,将为患者精准匹配最适合的治疗方案,助力胃癌治疗迈向新的高度。
秉承“基因科技造福人类”的使命,华大基因在癌症基因组学的基础研究上依托自主测序平台、核心精准数据及算法,构建了“预、筛、诊、监”的肿瘤基因检测闭环产品线,聚焦肿瘤防控难点,不断丰富创新技术、拓展服务模式、贴合早诊防治指南、响应市场新需求,开发并升级相应的基因检测产品,全面布局肿瘤防控工作,为更多人提供肿瘤诊疗的个性化解决方案,为健康保驾护航!
参考资料:
[1] Nakayama I, Qi C, Chen Y, Nakamura Y, Shen L, Shitara K. Claudin 18.2 as a novel therapeutic target. Nat Rev Clin Oncol. 2024;21(5):354-369. doi:10.1038/s41571-024-00874-2
[2] Shitara K, Lordick F, Bang Y-J, et al. Zolb etuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. The Lancet. 2023;401(10389):1655-1668.
[3] van Laarhoven HWM, Derks S. Claudin-18.2 targeting by zolbetuximab: results of SPOTLIGHT in perspective. Lancet. 2023;401(10389):1630-1631. doi:10.1016/S0140-6736(23)00732-8
[4] Shah MA, Shitara K, Ajani JA, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med. 2023;29(8):2133-2141. doi:10.1038/s41591-023-02465-7
[5] Zolbetuximab-clzb FDA批准文件
[6] CSCO胃癌诊疗指南2023版
[7] CSCO胃癌诊疗指南2024 版
推荐阅读



