Nature子刊 | 华大基因联合复旦大学附属中山医院等发布上消化道癌治疗研究
2024-10-16
上消化道癌症,如胃腺癌(GAC)和食管鳞癌(ESCC),是全球范围内高发的恶性肿瘤,尤其在中国,许多患者因早期症状不明显而错过最佳治疗时机,预后较差。传统的一线治疗方法虽然有一定效果,但对于一线治疗失败后的患者来说,二线及后续治疗选择依然有限。
2024年10月15日,复旦大学附属中山医院联合华大基因等在国际知名期刊Nature Communications发表新的临床研究成果:
纳武利尤单抗(Nivolumab)联合盐酸安罗替尼(Anlotinib hydrochloride)在一线治疗失败的晚期GAC和ESCC患者中,取得了显著的疗效和可控的安全性:客观缓解率(ORR)为29.2%,疾病控制率(DCR)为64.6%,中位无进展生存期(PFS)为4.0个月,中位总生存期(OS)为11.1个月,且副作用在可控范围内。这不仅为这些患者带来了新的治疗选择,也为未来的临床实践提供了宝贵的参考。(点击文末“阅读原文”,获取论文链接)

图源:Nature Communications
免疫+抗血管,优势何在?
肿瘤的生长并不是孤立的,而是通过改变血管生成、抑制免疫系统等方式,营造有利于其发展的肿瘤微环境。这使得肿瘤可以逃避免疫系统的攻击,并通过生成异常血管获得更多的养分。
血管内皮生长因子(VEGF)是在人体内主要负责调控血管生成和血管通透性的蛋白质,在癌症中经常被过度表达。抗血管生成药物,如盐酸安罗替尼(多靶点酪氨酸激酶受体抑制剂),通过抑制血管内皮生长因子受体(VEGFR)、成纤维细胞生长因子受体(FGFR)、血小板衍生生长因子受体(PDGFR)等多种靶点,阻断肿瘤新生血管的生成,切断肿瘤细胞所需的血液和营养供应,从而抑制肿瘤的生长和扩散。
另一方面,免疫检查点抑制剂(抗PD-1)通过阻断PD-1/PD-L1通路,重新激活T细胞的功能,使体内的免疫系统“重启”,对肿瘤发起攻击。两者的联合,阻止肿瘤血管的异常生长的同时,激活免疫系统去攻击肿瘤。
这样的“双管齐下”让肿瘤更难逃脱免疫系统的监视和控制。基于此机制,近年来,“免疫+抗血管”联合治疗正在成为肿瘤治疗新的临床实践探索方向。此前多项研究已证明:抗血管生成药物与免疫检查点抑制剂联合治疗在多种癌症中,如非小细胞肺癌(NSCLC)、软组织肉瘤、上皮性卵巢癌和肝细胞癌,表现出良好的治疗疗效和可耐受的毒性反应。
应答积极,副作用可控
随着免疫治疗的快速发展,PD-1抑制剂联合化疗成为GAC和ESCC一线治疗的标准方案。然而,一线治疗失败后的二线或后续治疗选择十分有限,疗效也不理想。晚期GAC和ESCC患者体能状态较差且对细胞毒性治疗的耐受性较差,亟需一种新的无化疗方案作为二线或后线治疗。
为了探索免疫联合抗血管治疗二线及以上GAC和ESCC的有效性和安全性,本次研究团队设计开展了一项前瞻性、单中心、单臂II期临床试验。2020年10月至2022年9月,研究团队招募了48名患者(包括45例GAC患者和3例ESCC患者),接受纳武利尤单抗联合盐酸安罗替尼治疗,评估客观缓解率(ORR)、总生存时间(OS)、疾病控制率(DCR)。
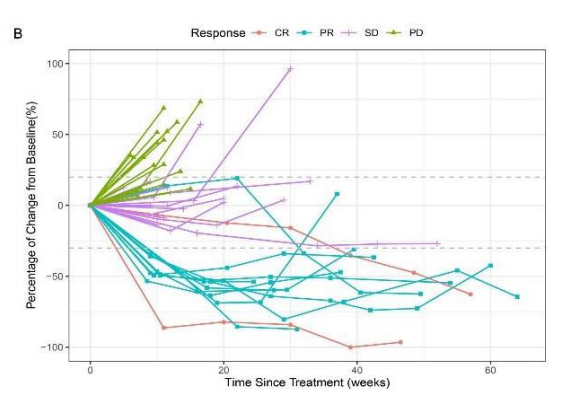
图注:患者的肿瘤负担变化情况
研究结果显示:整体ORR为29.2%,DCR为64.6%。其中在二线治疗患者中,ORR为32.3%,而在≥三线治疗患者中,ORR为23.5%。此外,二线治疗患者的中位总生存期(mOS)为14.5个月,而三线及以上患者mOS为7.6个月。这些数据表明,联合方案在晚期GAC和ESCC二线及以上治疗中表现出显著的疗效,尤其是在二线患者中,获得了更长的生存期。
研究过程中,超过79%的患者仅经历了轻度的1-2级治疗相关不良事件(TRAEs)。
揭秘治疗效果的“预报员”
此外,为了探索预测GAC患者对联合方案疗效的预后和预测生物标志物,研究团队基于临床试验,收集了患者肿瘤组织、血液、粪便样本,比较了不同疗效患者的分子特征。
分析发现,患者样本中的生物标志物,特别是血液中的循环肿瘤DNA(ctDNA),对于预测治疗效果具有重要意义。对大多数胃腺癌患者的基因组分析显示出TP53、NCOR2、LRP1B和MUC16等基因的高频突变,并且这些突变在组织样本和ctDNA中表现出高度一致性,证明ctDNA可以反映出肿瘤的基因特征。
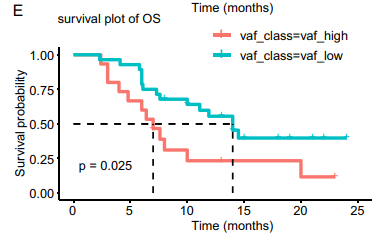
图注:治疗前ctDNA VAF与OS的关系
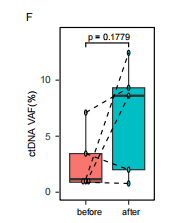
图注:治疗前和疾病进展后ctDNA VAF水平的变化
特别是,研究发现,治疗前ctDNA变异基因频率(ctDNA VAF)与患者的总生存期(OS)之间有显著关联。研究还表明,随着疾病进展,患者体内的ctDNA VAF水平往往会上升。这意味着,通过持续检测这种变异,医生可以更好地预测患者对治疗的反应,并调整治疗方案,更好地应对疾病变化。
“本项目表明,免疫联合抗血管治疗能作为晚期二线以上胃/食管癌的治疗策略,为开展大规模临床研究提供了重要意义。未来,研究团队计划在更大规模的多中心临床试验中进一步验证这一联合治疗的效果,同时也将继续深入研究生物标志物在预测疗效中的作用,以期为患者提供更精准、个性化的治疗选择。”该研究的共同作者、华大基因临床科研经理安国博士表示。
*复旦大学附属中山医院崔越宏教授、刘天舒教授,深圳华大基因股份有限公司靳大卫为该论文共同通讯作者。复旦大学附属中山医院吴菁博士、张世龙博士和于珊博士,深圳华大基因股份有限公司安国博士为论文共同第一作者。深圳华大基因股份有限公司吴逵研究员对项目给出建议。
*该项目的设计和实施严格遵照伦理规范开展,相关数据已完成中国人类遗传资源信息开放使用备案。本项临床试验OASIS,注册编号NCT04503967。
更多阅读
2022年,中国癌症总体粗死亡率为182.34/10万(男性 225.97/10万,女性136.79/10万),年龄标准化死亡率为96.47/10万,已经成为国家卫生健康的重大负担。WHO指出,肿瘤是人体自身细胞分化异常、基因突变累积的结果。在进行肿瘤治疗前,对患者进行基因突变检测,能对靶向、免疫治疗的疗效进行前瞻性的预测,为医生临床用药提供有效的参考,从而提高治疗的精准性。

点击此处,了解更多
基于泛癌种药物的应用发展,泛实体瘤基因检测也在临床得到了广泛的应用。紧贴NCCN指南和国内外专家共识的推荐,华梵安系列产品全新升级为华泛安®,是华大基因推出的实体瘤用药基因检测产品,适合绝大多数实体瘤患者,覆盖实体瘤相关的816个基因,一次性解决靶向用药、免疫治疗、遗传风险、化疗药物、分子分型、耐药检测六大临床需求,为实体瘤患者提供全方位的个体化精准诊疗方案。
华泛安®主要用于肺癌、乳腺癌、卵巢癌、子宫内膜癌、子宫颈癌、结直肠癌、胃癌、肝癌、肾癌、胰腺癌、胃肠道间质瘤、膀胱癌、口腔癌等实体肿瘤组织或血液进行基因检测,为靶向药物治疗、化疗药物治疗、免疫治疗提供基因检测结果,预测肿瘤的家族遗传性风险,给临床医生为患者选择最佳治疗方案或为筛选病人入组临床试验提供依据。
参考资料
[1] Fuchs, C. S., et al. "Safety and efficacy of pembrolizumab monotherapy in patients with previously treated advanced gastric and gastroesophageal junction cancer: phase 2 clinical KEYNOTE-059 trial." JAMA Oncology 4.5 (2018): e180013.
[2] Zhou, M., et al. "Anlotinib: a novel multi-targeting tyrosine kinase inhibitor in clinical development." Journal of Hematology & Oncology 11.1 (2018): 120.
[3] Diaz Jr, L. A., Bardelli, A. "Liquid biopsies: genotyping circulating tumor DNA." Journal of Clinical Oncology 32.6 (2014): 579-586.
[4] Abbosh, C., et al. "Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution." Nature 545.7655 (2017): 446-451.
推荐阅读



